Reacciones Químicas
Blog
Tecnológico de Campeche
Jan Carlo Lopez Cardozo
4.1. Combinación.
- Ley de Lavoisier o de conservación de la masa
- Ley de Proust o de las proporciones definidas
- Ley de Dalton o de las proporciones múltiples
- Ley de las proporciones reciprocas
Las cantidades de un mismo compuesto que se combinan con una cantidad fija de otro para formar varios compuestos están en una relación de números enteros sencillos 1:1: 2:1, 1:3, 3:1, etc.
Es la del peso equivalente que dice que digamos que 2 gramos de oxígeno equivalen a 1 de carbono, pero para el hidrogeno equivale a 4 gramos de él.
4.2. Descomposición
La descomposición química es un proceso que experimentan algunos compuestos químicos en el que, de modo espontáneo o provocado por algún agente externo, a partir de una sustancia compuesta se originan dos o más sustancias de estructura química más simple. Es el proceso opuesto a la síntesis química.
Tipos de descomposición
Existen 3 tipos de reacciones de descomposición, dependiendo del agente causante de ésta:
- Térmica: Producida por una temperatura elevada.
- Electrolítica: Producida por la corriente eléctrica
- Catalítica: Producida por la acción de un catalizador, que acelera una reacción que de otro modo sería muy lenta.
4.3 Sustitución (simple y doble)
Cuando una reacción implica un elemento que desplaza a otro en un compuesto, se llama reacción de sustitución simple o reacción de reposición simple. También se utiliza el nombre de "reacción de desplazamiento". Por ejemplo, una tira de cobre sumergida en una solución de nitrato de plata desplazará átomos de plata, produciendo nitrato de cobre y precipitación de cristales del metal plata.
Cu(s) + 2AgNO3(aq) -> 2 Ag(s) + Cu(NO3)2(aq)
Si el metal zinc se sumerge en un ácido, desplazará al hidrógeno del ácido.
ZN(s) + 2HCl(aq) -> 2 H2(g) + ZnCl2(aq)
Generalmente, los metales activos, desplazarán el hidrógeno de los ácidos.
Sustitución Doble
Cuando en una reacción aparece un intercambio de parte de los reactivos, la reacción se conoce como reacción de doble sustitución o reacción de doble reposición. Otro nombre utilizado para este tipo de reacciones es el de "reacciones de metátesis". Cuando los reactivos son compuestos iónicos en solución, los aniones y cationes de los compuestos se intercambian. Probablemente la más famosa de este tipo de reacciones entre los profesores de química sea la reacción entre el nitrato de plomo y el yoduro de potasio:
2KI(aq) + Pb(NO3)2(aq) -> 2KNO3(aq) + PbI(s)
4.4 Neutralización
Resultados de búsqueda
Fragmento destacado de la Web
4.5 Oxido-Reducción
4.6 Aplicaciones
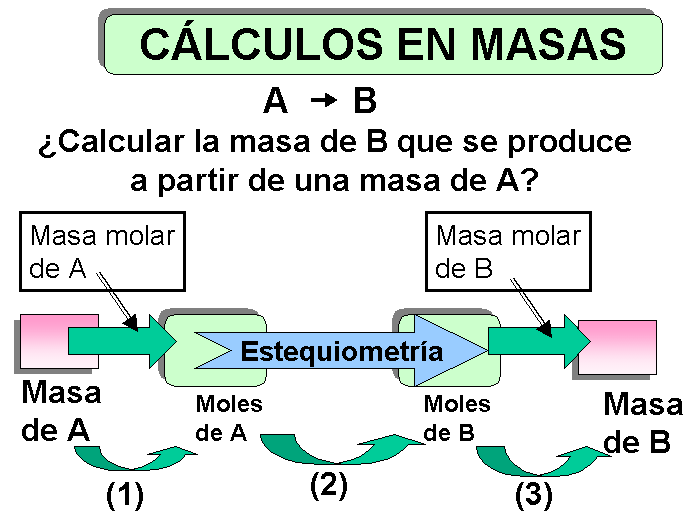
4.7 Cálculos estequiométricos con reacciones químicas
4.7.1Reacción óxido reducción en electroquímica
4.7.2 Fuerza electromotriz(fem) en una celda electroquímica.
La celda electroquímica es un dispositivo experimental para generar electricidad mediante una reacción redox espontánea en donde la sustancia oxidante está separada de la reductora de manera que los electrones deben atravesar un alambre de la sustancia reductora hacia la oxidante.
En una celda el agente reductor pierde electrones por tanto se oxida. El electrodo en donde se verifica la oxidación se llama ánodo. En el otro electrodo la sustancia oxidante gana electrones y por tanto se reduce. El electrodo en que se verifica la reducción se llama cátodo.
La corriente eléctrica fluye del ánodo al cátodo porque hay una diferencia de energía potencial entre los electrodos. La diferencia de potencial eléctrico entre el ánodo y el cátodo se mide en forma experimental con un voltímetro, donde la lectura es el voltaje de la celda
Tipos de celdas:
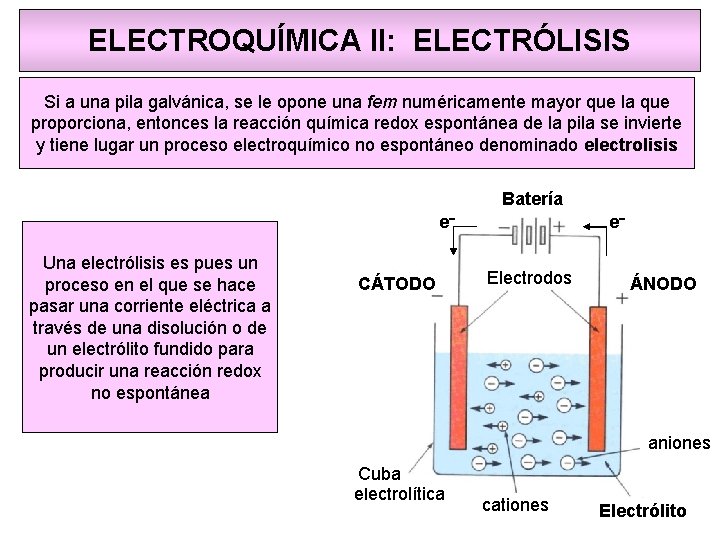
Cuba electrolítica, mostrando los electrodos y la fuente de alimentación que genera la corriente eléctrica.
- La celda voltaica transforma una reacción química espontánea en una corriente eléctrica, como las pilas y baterías. También reciben los nombres de celda galvánica, pila galvánica o pila voltaica.
La celda electrolítica transforma una corriente eléctrica en una reacción química de oxidación-reducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrolisis. También reciben los nombres de celda electrolítica o cuba electrolítica. A diferencia de la celda voltaica, en la celda electrolítica, los dos electrodos no necesitan estar separados, por lo que hay un sólo recipiente en el que tienen lugar las dos semirreacciones.
4.7.3 Calculo de la fem y potenciales de óxido reducción
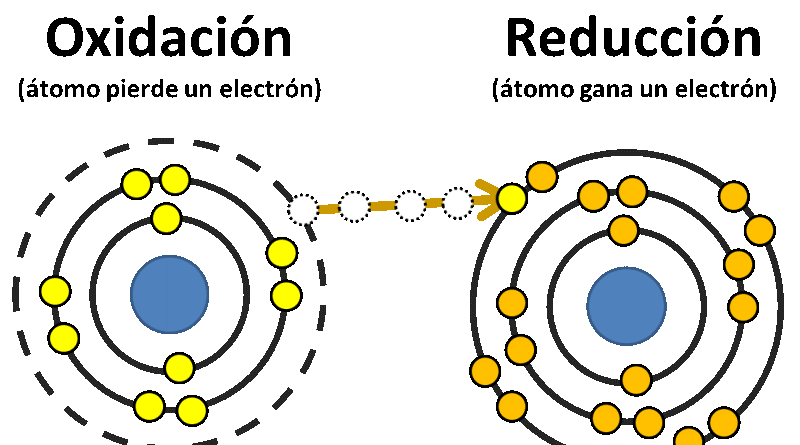
Se denomina reacción de reducción-oxidación (también, reacción de óxido-reducción o simplemente reacción rédox) a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones y otro que los acepte:
- El agente oxidante es aquel elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
- El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par rédox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par rédox con su precursor oxidado. Cuando una especie puede oxidarse, y a la vez reducirse, se le denomina anfolito, y al proceso de la oxidación-reducción de esta especie se le llama anodización o disminución.
4.7.4 Electro depósito (Calculo de electro deposito)

La electroposición se utiliza principalmente para conferir una capa con una propiedad deseada (por ejemplo, resistencia a la abrasión y al desgaste, protección frente a la corrosión, la necesidad de lubricación, cualidades estéticas, etc.) a una superficie que de otro modo carece de esa propiedad. Otra aplicación de la electroposición es recrecer el espesor de las piezas desgastadas p.e. mediante el cromo duro.

4.7.5 Aplicaciones de electroquímica en electrónica.
4.7.6 nanoquímica (propiedades fisicoquímicas no convencionales de polímeros, catenanos y rotaxanos).
- Catenanos: Estructuras formadas por la interconexión de dos o más macro-ciclos para formar una cadena, con cada macro-ciclos tomando el papel de un eslabón.
Catenanos

- Rotaxanos: Estructuras con una molécula en forma de mancuerna rodeada en el centro por un macro-ciclos Los rotaxanos son potencialmente máquinas moleculares que se podrían usar en electrónica molecular como interruptores lógicos o transportadores. Su funcionamiento se basaría en el movimiento del macrociclo respecto a la molécula central (la del eje y las “pesas”)..
Rotaxanos
Los primeros Catenanos y Rotaxanos fueron sintetizados en 1960, pero no fue sino hasta hace unos años que se empezaron a considerar estas estructuras como posibles fuentes de una aplicación importante.
La síntesis de este tipo de estructuras era muy difícil ya que se utilizaban únicamente fuerzas intermoleculares e interacciones ácido-base para dirigir la reacción. En la actualidad ya no existen ese tipo de impedimentos ya que se han diseñado métodos de síntesis que incorporan metales de transición para dirigir la reacción. Uno de los metales más empleados para esto es el cobre en estado de oxidación.








No hay comentarios.:
Publicar un comentario